
Los het volgende probleem op:
We hebben een glas rode wijn en een tweede glas met witte wijn. We brengen nu een hoeveelheid van de rode wijn in het glas met witte wijn en brengen vervolgens een even grote hoeveelheid uit het tweede glas (met als inhoud witte en een beetje rode wijn) in de rode wijn. Het ene glas bevat nu vooral rode wijn met een kleine hoeveelheid witte wijn, terwijl het andere glas vooral witte wijn met een kleine hoeveelheid rode wijn bevat.
Vraag: Wat valt nu te zeggen over deze kleine hoeveelheden? Is de kleine hoeveelheid witte wijn in de rode even groot als de kleine hoeveelheid rode wijn in de witte, of zijn de hoeveelheden verschillend?
a. geef eerst een intuïtief antwoord.
b. geef vervolgens een beredeneerd antwoord.
c. geef aan van welke veronderstellingen is uitgegaan bij het antwoord onder b.
d. vergelijk de verschillende antwoorden en de argumentaties.
Veel berekeningen in de chemie zijn berekeningen met verhoudingen: dichtheden, berekeningen van mol naar gram, gehaltes en concentraties etc.
Eén grootheid is gedefinieerd als de verhouding van twee andere grootheden. Vaak is het zo dat de verhouding van twee extensieve grootheden (grootheden die afhangen van de grootte van het systeem, zoals massa en volume) een intensieve grootheid oplevert (deze hangt niet af van de omvang is daarmee een eigenschap van het systeem, zoals dichtheid, concentratie). Daarom kun je ook niet spreken van de dichtheid van een stuiver: je kunt wel de dichtheid van het materiaal, waaruit de stuiver bestaat, bepalen.
Bij het verhoudingsrekenen gaat het er steeds om de waarde van een grootheid te berekenen als twee andere bekend zijn.
Nemen we als voorbeeld dichtheid dan zijn de type berekeningen:
Het is bekend dat leerlingen veelvuldig fouten maken bij het uitvoeren van verhoudingsberekeningen.
Wat zijn de belangrijkste problemen voor leerlingen bij het maken van verhoudingsberekeningen?
Bereken het volume van 5,00 gram alcohol (dichtheid 0,80 g/ml).
Welke methode is bij de oplossing van dit probleem gebruikt?
Bij het beschrijven van methoden voor het oplossen van problemen wordt wel onderscheid gemaakt in algoritmen en heuristieken.
Een algoritme is een regel of een voorschrift bestaande uit meerdere regels die bij juiste toepassing altijd leidt tot een juiste oplossing.
Voorbeelden zijn: een staartdeling, een methode voor het opzoeken van een telefoonnummer in een telefoonboek, bedieningsinstructies voor een apparaat e.d. Algoritmen zijn in de meeste gevallen ook door een computer uit te voeren.
Voor verhoudingsopgaven zijn er verschillende algoritmen in gebruik. Hieronder worden deze methoden gebruikt bij het oplossen van het probleem uit opdracht 3.
| 1 | ml alcohol weegt | 0,80 gram |
| 1 — 0,80 |
ml alcohol weegt | 1,00 gram |
| 1 × 5 — 0,80 |
ml alcohol weegt | 5,00 gram |

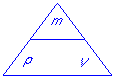
Uit het driehoekje valt af te lezen:
ρ = m / V
V = m / ρ
m = ρ · V
In feite is dit een ondersteuning (“ezelsbrug”) van 2.
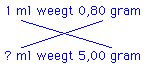
Het kruisproduct: ? × 0,80 = 1 × 5,00 ⇒ ? = 5,00 / 0,80
Deze methode is populair in het VO. Leerlingen maken (maakten) er bij het vak wiskunde kennis mee.
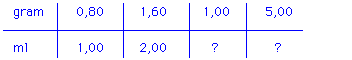
Deze tabel is in meerdere opzichten nuttig. Vooral omdat leerlingen zien dat het onderste getal altijd groter is dan het bovenste. Bij berekeningen is er deze controlemogelijkheid (onjuistheden vallen sneller op).
Voor berekeningen is het het handigst om te combineren met het kruisproduct:
? × 0,80 = 1 × 5,00 ⇒ ? = 5,00 / 0,80
Bij het kennis maken met een verhoudingseenheid is het nuttig leerlingen een verhoudingstabel te laten maken.
Los het volgende probleem (individueel!) op:
Op een school wordt gewerkt met deelproefwerkcijfers, proefwerkcijfers en rapportcijfers.
De vraag: welk cijfer moet deze leerling halen voor het laatste deelproefwerk om nog een 6 te halen op het rapport?
Opmerkingen:
Voor ingewikkelder rekenproblemen, zoals bovenstaand, kan een Systematisch ProbleemAanpak (SPA) nuttig zijn. Een SPA is een heuristiek d.w.z. een aantal globale aanwijzingen die kunnen helpen bij het vinden van een oplossing voor een probleem.
Een SPA bestaat uit een aantal stappen, die leerlingen successievelijk af moeten werken om op systematische wijze naar een oplossing te zoeken. Vooral voor leerlingen die niet weten waar te beginnen of snel de draad kwijt raken, kan een dergelijke aanpak uitermate nuttig zijn. De SLO heeft een uitwerking van een SPA uitgegeven (zie literatuur). Het “leren probleemoplossen” is in de nieuwe leerplannen VO een vast onderdeel geworden. Dit betekent dat van leerlingen verwacht kan worden dat ze er bekend mee zijn.
Ten aanzien van SPA’s kan nog het volgende opgemerkt worden:
Literatuur
Wat zijn de fasen en stappen van SPA? uit: Jansen, G., & Hondebrink, J. (1991). Hoe pak ik een probleem aan? Enschede: SLO.
![]() Het fragment “Wat zijn de fasen en stappen van SPA?” is als pdf-file te lezen (240K)
Het fragment “Wat zijn de fasen en stappen van SPA?” is als pdf-file te lezen (240K)
Vaak wordt voor leerlingen het maken van verhoudingsberekeningen het toepassen van regels zonder dat dit tot enig begrip leidt. Waarschijnlijk zijn de problemen van leerlingen op dit gebied voor een belangrijk deel daaraan te wijten.
Zowel het gebruik van algoritmen als heuristieken kunnen leerlingen helpen, maar leiden niet tot echt begrip. Hieronder een aantal opmerkingen die oplossingen kunnen bieden of die de problemen in vakinhoudelijk opzicht verduidelijken.
Hoewel gehalteberekeningen in principe analoog zijn aan dichtheidsberekeningen, zijn er toch een aantal specifieke punten m.b.t. het rekenen met concentraties en gehaltes.
Met name het rekenen met volumeprocenten geeft problemen.
Bedenk een methode om zo nauwkeurig mogelijk een oplossing te bereiden van 5 % (v/v) alcohol in water.
Leerlingen blijken vooral problemen te hebben met het intensieve karakter van de grootheid “concentratie”. In een onderzoek is aan leerlingen (4 havo) de volgende vraag voorgelegd (Jong, O. de (1996). Zeitschrift für Didaktik der Naturwissenschaften 2 (1) 3-10):
Een vat (1,0 liter) wordt met een soda-oplossing(concentratie 5 g/l) gevuld.
Welke concentratie heeft een grote druppel (0,1 ml) van deze oplossing?
Het bleek dat ongeveer 10 % van de leerlingen deze vraag fout beantwoorden (bijv. 0,5 mg/l) en dat nog eens 30 % van de leerlingen het - op zich juiste - antwoord gaf van 0,5 mg / 0,1 ml. Deze laatste groep leerlingen maakt echter geen gebruik van het intensieve karakter van de grootheid “concentratie”.
Literatuur
Jong, O. de (1991). Chemisch rekenen: kruis of mol? NVON-maandblad 16, (3), 85-88.
![]() Het artikel is als pdf-file te lezen (556K)
Het artikel is als pdf-file te lezen (556K)
In het LAO (Lager Agrarisch Onderwijs) wordt met succes een methodiek toegepast om leerlingen meer begrip bij te brengen voor het werken met verhoudingen. Leerlingen maken dan een tabel van massa’s en volumes voor een bepaalde stof. Vervolgens doen zij hetzelfde voor andere stoffen (voorbeelden: water, alcohol, suiker, zout, ijzerkorrels, loodkorrels etc). Leerlingen gaan dan spreken van “het gelijk opgaan van de massa met het volume”. Vervolgens maken zij een grafiek waarin zij uitzetten massa tegen volume voor de onderzochte stoffen. Zij zien dan dat de helling van deze grafiek “te maken heeft met de stof” en dus een karakteristieke grootheid voor deze stof genoemd kan worden. Met deze methodiek leren leerlingen dichtheid dan kennen als intensieve grootheid.
In deze aanpak staat het “ontdekkend leren” centraal.
Literatuur
Landelijke werkgroep LAO (1988). Ontwerp scheikunde-opdrachten voor het lager agrarisch onderwijs.![]() Een deel van de tekst is als pdf-file te lezen (236K)
Een deel van de tekst is als pdf-file te lezen (236K)
Door de introductie van de calculator in het onderwijs is het afronden van berekende getallen van belang geworden. Hiervoor zijn een aantal vuistregels opgesteld. Het principe is dat van getallen alleen de betekenisvolle cijfers (“significante cijfers”) worden vermeld. Dit geldt zowel voor de gegeven getallen in de opgave als voor het uiteindelijk antwoord. In het artikel van Morélis staan de regels gegeven bij het afronden van rekenresultaten, zoals die aan leerlingen in het VO worden geleerd. Een jaar eerder gaven Goedhart & Verdonk kritiek op het gebruik van de significante cijfers.
Literatuur
Goedhart, M.J. & Verdonk, A.H. (1989). Significante cijfers bij rekenen en meten. NVON-maandblad, 14(9), 397-399.
![]() Het artikel is als pdf-file te lezen (460K)
Het artikel is als pdf-file te lezen (460K)
Morélis, J. (1990). Significante cijfers : hoe zit dat nou? NVON-maandblad, 15(10) 428- 430.
![]() Het artikel is als pdf-file te lezen (332K)
Het artikel is als pdf-file te lezen (332K)
Chemisch rekenen verschilt van gewoon rekenen omdat er niet alleen met getallen wordt gerekend, maar met grootheden. Achter de meeste getallen hoort dus een eenheid. Bij het werken met formules en de dimensiemethode maak je daar gebruik van. Veel leerlingen vinden het overigens raar om eenheden op elkaar te delen of met elkaar te vermenigvuldigen: “Hoe kan je nou kilo’s door liters delen, je kunt toch ook geen appels en peren door elkaar delen?”
Alle grootheden en eenheden zijn in het SI afgeleid van zeven basisgrootheden en grondeenheden, elk met een eigen symbool: noot
| grootheid | symbool | eenheid | symbool |
| lengte | l | meter | m |
| massa | m | kilogram | kg |
| tijd | t | seconde | s |
| stroomsterkte | I | ampère | A |
| temperatuur | T | kelvin | K |
| lichtsterkte | Iv | candela | cd |
| hoeveelheid stof | n | mol | mol |
Andere grootheden en eenheden zijn hiervan afgeleid. Hoewel de kubieke meter (m3) de eenheid van volume is, wordt in de scheikunde de liter (l) gebruikt. Ondanks dat liter geen naam van een geleerde (zoals Ampère, Newton of Kelvin) is, is het steeds meer gebruikelijk om een hoofdletter L te gebruiken als symbool. (Als je de namen van eenheden voluit schrijft, dan moet dat met een kleine letter!)
De eenheid die onze speciale aandacht verdient is de mol. Er treedt vaak verwarring op met het getal van Avogadro (ook wel: constante van Avogadro): NA = 6,02214 × 1023 mol-1 (volgens BINAS-tabel 7), NA = 6.022 140 857 × 1023 mol-1 (volgens de NIST). Het artikel van Furió, Guisasola & Ratcliffe (2000) gaat in op de problemen die leraren hiermee hebben.
a. Beargumenteer of het aantal atomen in exact 12 gram koolstof-12 een geheel getal is.
b. In een artikel in het nieuwsblad van de IUPAC stellen Ian Mills en Martin Milton een nieuwe definitie van de mol voor. Welke voordelen heeft deze definitie? Wat zou het gevolg zijn voor het antwoord op 6a?
c. Bekijk maar eens de toelichting van Professor Poliakoff over dit voorstel:
Literatuur
Furió, C., Azcona, R., Guisasola, J., & Ratcliffe, M. (2000). Difficulties in teaching the concepts of ‘amount of substance’ and ‘mole’. International Journal of Science Education, 22 (12), 1285-1304.
![]() Het artikel is als pdf-file te lezen (220K)
Het artikel is als pdf-file te lezen (220K)
Mills, I., & Milton, M. (2009). Amount of substance and the mole [Electronic Version]. Chemistry International , 31. Geraadpleegd 11 augustus 2009, van http://www.iupac.org/publications/ci/2009/3102/1_mills.html
Noten
Voor meer details over het stelsel van SI-eenheden verwijs ik graag naar de website van het Bureau International des Poids et Mesures (BIPM).
Bijgewerkt op zondag 1 maart 2020.